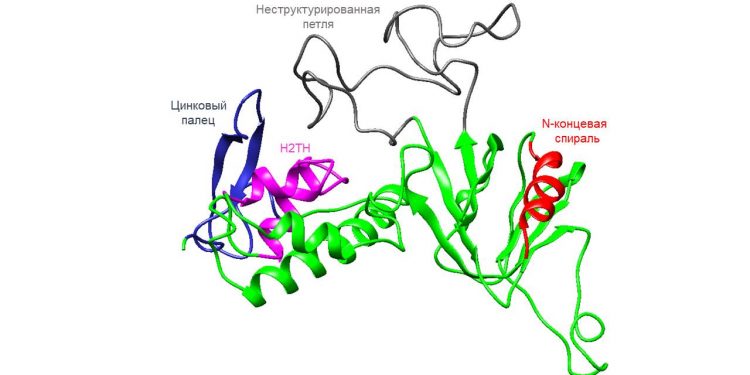
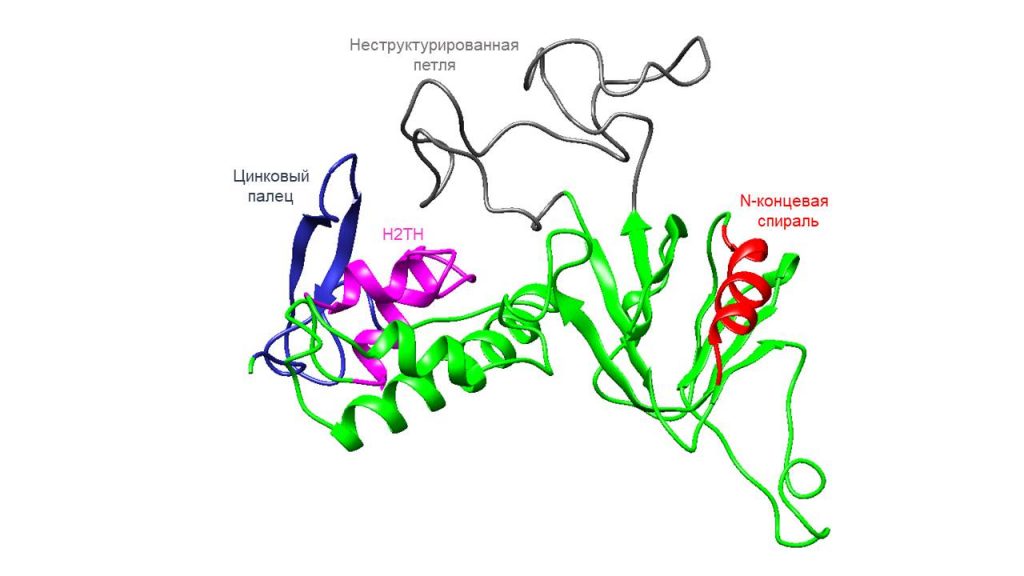
Ученым Института химической биологии и фундаментальной медицины СО РАН впервые в мире удалось получить структуру человеческого варианта белка hNEIL2. Этот белок восстанавливает поврежденные участки ДНК. В перспективе данные о его структуре помогут бороться с онкологическими и нейродегенеративными заболеваниями. Результаты исследования опубликованы в Journal of Molecular Biology.
Белок HNEIL2 открыт в 2002 году и с этих пор вызывает большой интерес ученых. С одной стороны, будучи белком репарации, он отвечает за стабильность генома и восстанавливает широкий спектр повреждений. С другой — его активность важно ингибировать (подавлять) во время химиотерапии при лечении онкологических заболеваний, потому что HNEIL2 помогает эффективно восстанавливаться в том числе онкологическим клеткам.
Несмотря на повышенный интерес к hNEIL2, ученым до сих пор не удавалось расшифровать его структуру. Проблема в том, что этот белок состоит из двух доменов, соединенных подвижным элементом, не дающим получить кристалл, структура которого была бы достаточно воспроизводима. Лишь одна исследовательская группа недавно расшифровала структуру похожего на hNEIL2 белка домашнего опоссума.
Ученые ИХБФМ СО РАН первыми в мире смогли получить структуру hNEIL2 с помощью метода HDX-MS. Это метод масс-спектрометрии, где водород заменяется на дейтерий, что позволяет исследовать структуры белков в растворе. Недавно институт прибрел дорогостоящее оборудование, позволяющее развивать HDX-MS в России.
«Этот метод прогрессивный, интересный и широко востребованный в мире. В последние два года большинство групп, которые занимаются HDX, изучают с помощью него структуру белков коронавируса, а также антител против COVID-19», — рассказал заместитель директора и руководитель Объединенного центра геномных, протеомных и метаболомных исследований ИХБФМ СО РАН кандидат химических наук Владимир Васильевич Коваль.
Кроме того, HDX-MS позволяет достаточно быстро и просто характеризовать белковые терапевтические препараты с точки зрения их соответствия заявленному образцу. В отличие от химически синтезированных, белковые лекарства требуют такой проверки каждый раз перед выпуском в продажу.
Сейчас ученые ИХБФМ ведут работы по расшифровке структуры hNEIL2, чтобы иметь четкое представление о том, как выглядит белок, какова его структурная укладка и как он расположен в пространстве. Исследования проводятся в рамках гранта РНФ № 20-14-00214 «Система геномного редактирования на основе эндонуклеазы Cas9: структурные факторы узнавания целевых ДНК». В планах — наблюдать за тем, как белок hNEIL2 изменяется при взаимодействии со своими ДНК-субстратами, а также изучить, насколько его свойства зависят от структуры.
Владимир Коваль рассказал, что исследование белка HNEIL2 должно дать толчок отечественным исследованиям по структурной биологии. Эта область науки переживала взрывной рост в 1990—1992-х годах по всему миру. В России же в это время была перестройка, в результате которой у нас практически не осталось мощных научных групп, занимающихся структурной биологией.
«Человек — фабрика химических реакций. Как только мы узнаем структуры белков, которые проводят ту или иную реакцию, мы можем начинать ее регулировать», — рассказывает ученый. На знании о структуре белков построены современные обезболивающие, большинство новых противовирусных препаратов. В том числе два низкомолекулярных ингибитора ферментов коронавируса, которые вот-вот должны быть одобрены к применению в Европе. Благодаря структурной биологии практически удалось победить гепатиты С и B (терапия дорогая, но она есть).
«Изучив структуры белка hNEIL2, мы получили технологическую базу, знания и компетенции, которые в дальнейшем сможем использовать как инструментарий для точного определения структуры белковых комплексов, в том числе и с помощью синхротронного излучения», — отметил Владимир Коваль.
Методы молекулярной кристаллографии, до сих пор не представленные в России, будут развиваться на Сибирском кольцевом источнике фотонов. ИХБФМ является оператором станции на СКИФ, которая отвечает за макромолекулярную кристаллографию белков. Эту станцию планируется построить в рамках первой очереди синхротрона. Предполагается, что она начнет работу уже в 2024 году.
Сейчас, чтобы прочитать структуру белка, российские ученые ездят в Великобританию, Францию, США либо Израиль. Это долго, дорого и логистически сложно, потому что транспортировка белка требует специальных условий. К тому же некоторые исследования представляют собой коммерческую тайну, и их не вывезешь за рубеж. СКИФ позволит избежать этой проблемы.
«СКИФ — это что-то революционное, по значимости сопоставимое со строительством новосибирского Академгородка. Я уверен, что это разовьет многие научные области, — говорит Владимир Коваль. — Грубо говоря, СКИФ представляет собой очень мощный огромный микроскоп, который по атомам показывает белок. Мы можем посмотреть, как эти атомы расположены, увидеть расстояния между ними. Зная, как выглядит активный центр ферментов, как он меняется в динамике, можно уже подбирать лекарства. Причем на первом-втором этапе ничего синтезировать не приходится, система поиска подгонки сама ищет соединения и вычисляет, какое из них подходит лучше».
Помимо станции на СКИФ, сибирские ученые планируют развивать и другие методы молекулярной кристаллографии. Дело в том, что не все белки могут быть прочитаны с помощью синхротрона. Ему нужна кристаллическая регулярная структура, а у нас в клетках достаточно много белков, которые не кристаллизуются либо не растворяются в воде. Если такой белок небольшой, его изучают с помощью примененного в этом исследовании метода HDX-MS. Если, наоборот, гигантский (больше 100—120 килодальтон), на помощь приходит криоэлектронная микроскопия.
Сегодня криоэлектронные микроскопы в качестве дополнительного оборудования имеют большинство мировых синхротронов. В Новосибирске такой установки пока не планируется, поскольку ее стоимость — больше миллиарда рублей, что сопоставимо со стоимостью одной станции на СКИФ. Однако сейчас ученые пытаются найти финансирование для криоэлектронного микроскопа, так как он существенно увеличивает возможности для исследований.
Автор: Диана Хомякова
Источник: Наука в Сибири